こんにちは!
ぶっでぃです^^
さっそく有機化学の講義本体に入っていきます!
今回は、結合論(その1)「周期表と電気陰性度」をテーマにお伝えしていきます。
※結合論については有機化学の学習において「基礎中の基礎」となる重要な箇所ですから、かなり重点的にお伝えしています。
※なお、ここで述べることの理論的根拠は量子化学で学びますから、楽しみにしておいてください。
周期表と電気陰性度
ポイント1 そもそも化学結合とは
- 化学結合は、お互いの最外殻電子を、どのように持ち合うかの様々な形である。
ポイント2 結合の形態
>>詳しくはコチラの講義で解説しています。
- 有機化学で重要な化学結合のうち、最外殻電子を、お互いの原子核間の空間に持ち合う(=共有する)形態を持つ結合を、共有結合と呼ぶ
- 有機化学で重要な化学結合のうち、最外殻電子を、片方の原子核に引き寄せられ(=陰イオンとなる)、他方の原子核には本来の電子数(原子番号)より少ない電子しかない状態(=陽イオン)となる結合様式を、イオン結合と呼ぶ
- 実際は、ほぼ共有結合と呼べるもの、ほぼイオン結合と呼べるもの、中間の形態をとるものが存在する。
ポイント3 周期表とは
- 周期表とは、元素を性質ごとに(とくに電子配置ごとに)系統的に並べたもの
- 縦の列は最外殻電子の数が同じもの(※)。こうすることで、私たちの目の前に表す「物質としての性質」と、「化学反応」において、似た者同士として並べることができる。
※厳密には違うのですが、有機化学においてはそのような理解でOKです。 - 有機化学で頻出の元素は限られているので、これらの性質をまず押さえておく。
⇒H, Li, Na, K, B, C, N, O, F, Si, P, S, Cl, Br, I
※Br, Iは動画に含まれていませんでしたが重要な元素なので追加いたします。
ポイント4 電気陰性度とは
- 電気陰性度とは、原子核が最外殻電子を、どの程度惹きつけやすいか?という相対的な指標である。
- 周期表の右上に行くほど、電気陰性度は大きくなる
- 電気陰性度の差が小さい原子同士が共有結合、電気陰性度の差が大きい原子同士がイオン結合となる傾向がある。
例題
※重要なものばかりなので、すべて覚えましょう。
C-C
電気陰性度の差がゼロ(同一原子同士の結合なので当然)なので、共有結合である
C-H
電気陰性度の差が小さく、共有結合である
C-O
電気陰性度の差が小さく、共有結合である
…であるが、
電気陰性度は C(2.55) < O(3.44) であり、Oに電子が局在化する。
つまり、Oに若干の負電荷が偏る。
電子の局在化(=負電荷の偏り)を、「δ-」表現する。
逆に電子の不足(=正電荷の方より)を、「δ+」と表現する。

C=O
CとOが二重結合(後述)によって結ばれているが、
電気陰性度の観点からは単結合(C-O)と同じ考え方でよい。
すなわち、共有結合であるが、Oに若干の負電荷が偏る、のである。
C-N
こちらもC-Oと同じ考え方でよい。
電気陰性度の差が小さく、共有結合である
電気陰性度は C(2.55) < N(3.04) であり、Nに電子が局在化する。
つまり、Nに若干の負電荷が偏る。
C-Cl
こちらもC-Oと同じ考え方でよい。
電気陰性度の差が小さく、共有結合である
電気陰性度は C(2.55) < Cl(3.16) であり、Clに電子が局在化する。
つまり、Clに若干の負電荷が偏る。
※動画中では結合の線「―」からClに矢印を引いていますが、これは後述する「求核置換反応」においてClが「脱離基」としての作用しやすいことを意識して書いたものです。
C-Li
これまで電気陰性度の差が1未満のものを扱ってきたが、
ここでは C(2.55) > Li(0.98) と、電気陰性度の差が1.57もある。
またLiがイオン化傾向の大きい元素であることも相まって、
C-Li結合はイオン結合である。
しかも、Cが陰イオンになるタイプ。
※Cが陽イオンになる場合もある。Cは電気陰性度の観点から、陽イオン、陰イオン、どちらにもなりうる。有機化学ではどちらも出てくるので注意されたい。
N-Cl
※若干上級者向け。上記の例外として。Nが4級である場合のみ
電気陰性度の観点からは、 N(3.04) ≒ Cl(3.16) であるので、
共有結合しそうに見えるが、有機化学においてはN-Clの共有結合はほとんど見かけない。
Nは5個の最外殻電子を持っているため、
オクテットを則(=最外殻電子を見かけ上8個にして安定化する作用)を満たすために、
3つの結合を作りやすい。
オクテット則を満たすという意味でも、電気的中性による安定化という意味でも、本来はこれで十分なのだが、
実はNは元々もっている5個の電子のうち、共有結合に使う3つの電子に対して、
「あまり」である2つの電子を使って「孤立電子対」を、すでに形成している。
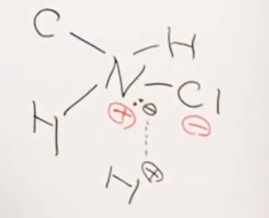
ここへ、電子が欲しいH+(プロトン、水素陽イオン)などが接近してきて、4級アンモニウムイオン(陽イオン)になる。
一方、Clはというと、自身の大きな電気陰性度のせいで、
Hからすでに電子を1個奪い取っており、塩化物イオンCl-(陰イオン)となっている。
※先述のH+はこのようにして形成している。
これらが相互にクーロン引力で惹きつけあい、イオン結合を形成するのである。
【注目】
【2025年初期研修修了まで限定】ぶっでぃの学習指導6年間の集大成 プレゼント開始しました!

最終合格率65.0%のプライベート・コンサルティング(20名受講中13名合格)で培った、
勉強法、計画法のノウハウ、二次試験対策コンテンツ、対面指導での質疑などをまとめました。
あなたの医学部編入試験勉強をトータルでサポートする内容で、
得られるベネフィットはプライベート・コンサルティング受講を超える内容です。
ぶっでぃの医学部卒業までに限定してLINE友達登録いただいた方全員にプレゼントいたします。
今すぐ登録してこの1年の勉強に存分に生かしてください。

>>プレゼントページをクリックして詳細をチェック!

