この記事の要点
- 「形式電荷」の計算方法について解説する。
- 形式電荷は、分子内の電荷分布を形式的に表すもので、「どの原子が攻撃されるか」を予測する重要な指標となる。
- 形式電荷は、(元の最外殻電子数)-(非共有電子対の電子数)-(共有結合の数)という定義式で計算できる。
- 例として、メタン(CH4)の炭素(C)は、(4)-(0)-(4)= 0 となる。
- ホルムアルデヒド(C=O)の酸素(O)は、2組の非共有電子対(ローンペア)を持つため、(6)-(4)-(2)= 0 となる。
- 動画内では、他の原子についても、この計算方法を用いた例題を豊富に用意した。
こんにちは!
ぶっでぃです^^
今回は、結合論(その4-1)「形式電荷」をテーマにお伝えしていきます。
※結合論については有機化学の学習において「基礎中の基礎」となる重要な箇所ですから、かなり重点的にお伝えしています。
※なお、ここで述べることの理論的根拠は量子化学で学びますから、楽しみにしておいてください。
目次
形式電荷
ポイント 形式電荷とは
- 有機化合物の分子内の電荷分布を、「形式的に表す」方法。
- 形式電荷の最も有用な使途は、どの原子がどの原子に攻撃するか、の指標である。
- 定義:
(形式電荷)=(最外殻電子数※1) – (結合に寄与しない最外殻電子数※2) – (共有結合数)
※1 電気的中性の単独原子における場合の。
※2 最外殻電子でないものは含まない
以下、いくつか例を挙げて説明する。
例1 メタンのC
-
- 最外殻電子数
 1s軌道に2個、2s軌道に2個、2p軌道に2個の電子が収まっている。
1s軌道に2個、2s軌道に2個、2p軌道に2個の電子が収まっている。
最外殻電子とは、主量子数が最も大きな軌道にある電子のことであるから、
2sおよび2p軌道に収まっている合計4個の電子が最外殻電子である。
- 最外殻電子数
-
- 結合に寄与しない最外殻電子数
 まずは4個のHから、それぞれ電子1個を差し出され、
まずは4個のHから、それぞれ電子1個を差し出され、
 Cからは、最外殻電子4つのうちすべてが差し出され、共有結合を形成した。
Cからは、最外殻電子4つのうちすべてが差し出され、共有結合を形成した。
すなわち、結合に寄与しない最外殻電子数はゼロである。
- 結合に寄与しない最外殻電子数
-
- 共有結合数 : 上図のとおり、共有結合数は4個である。
- すなわち、(形式電荷)=4-0-4=0である。
例2 ホルムアルデヒドのO
-
- 最外殻電子数
 Cのときと同様の考え方で、最外殻電子数は6
Cのときと同様の考え方で、最外殻電子数は6
- 最外殻電子数
-
- 結合に寄与しない最外殻電子数
 Oの最外殻電子の様子(=結合に寄与するか否か)を考えるにあたり、まずはCから考える。
Oの最外殻電子の様子(=結合に寄与するか否か)を考えるにあたり、まずはCから考える。
Cは最外殻電子4個すべてを差し出す。
 次に2つのHは、それぞれ最外殻電子1個ずつを差し出す。
次に2つのHは、それぞれ最外殻電子1個ずつを差し出す。
その結果、C-Hの単結合が2本形成される。
 次にOであるが、最外殻電子6個のうち、2個を結合に差し出す。
次にOであるが、最外殻電子6個のうち、2個を結合に差し出す。
Oからの2個の電子と、Cからの2個の電子(上述)とが、sp2軌道およびp軌道による2重結合を形成する。
このとき、Oの混成状態はsp2であるが、全部で3本あるsp2軌道のうち、まだ2本が残っている。
これに対して、ちょうど最外殻電子が4個余っているので、残っている2本の軌道に、電子が2つずつスピンを形成して収まる。
これを非共有電子対(ローンペア)という。これは共有結合に寄与しない電子である。
いま、Oのローンペアは2つであり、1つのローンペアには2個の電子が収まっているのだから、
合計4個の電子が共有結合に寄与しない最外殻電子であると結論付けられる。
- 結合に寄与しない最外殻電子数
-
- 共有結合数 : 二重結合は結合数2とカウントする。いま、二重結合数がなので、共有結合数は2である。
- すなわち、(形式電荷)=6-4-2=0である。
その他例題
動画に豊富に取り揃えましたので、ぜひ参照されたい。
【注目】
【2028年 小児科専攻医 修了まで限定】ぶっでぃの学習指導6年間の集大成 プレゼント開始しました!
※ご注意:予告なく終了することがございます

最終合格率65.0%のプライベート・コンサルティング(20名受講中13名合格)で培った、
勉強法、計画法のノウハウ、二次試験対策コンテンツ、対面指導での質疑などをまとめました。
あなたの医学部編入試験勉強をトータルでサポートする内容で、
得られるベネフィットはプライベート・コンサルティング受講を超える内容です。
ぶっでぃの医学部卒業までに限定してLINE友達登録いただいた方全員にプレゼントいたします。
今すぐ登録してこの1年の勉強に存分に生かしてください。

>>プレゼントページをクリックして詳細をチェック!

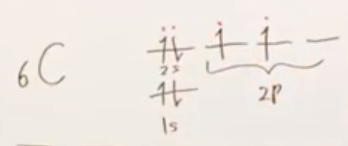 1s軌道に2個、2s軌道に2個、2p軌道に2個の電子が収まっている。
1s軌道に2個、2s軌道に2個、2p軌道に2個の電子が収まっている。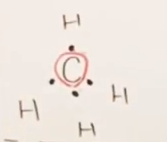 まずは4個のHから、それぞれ電子1個を差し出され、
まずは4個のHから、それぞれ電子1個を差し出され、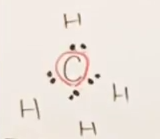 Cからは、最外殻電子4つのうちすべてが差し出され、共有結合を形成した。
Cからは、最外殻電子4つのうちすべてが差し出され、共有結合を形成した。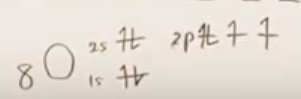 Cのときと同様の考え方で、
Cのときと同様の考え方で、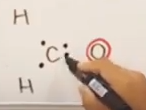 Oの最外殻電子の様子(=結合に寄与するか否か)を考えるにあたり、まずはCから考える。
Oの最外殻電子の様子(=結合に寄与するか否か)を考えるにあたり、まずはCから考える。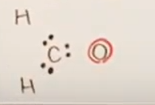 次に2つのHは、それぞれ最外殻電子1個ずつを差し出す。
次に2つのHは、それぞれ最外殻電子1個ずつを差し出す。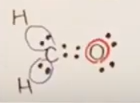 次にOであるが、最外殻電子6個のうち、2個を結合に差し出す。
次にOであるが、最外殻電子6個のうち、2個を結合に差し出す。
コメント
コメント一覧 (3件)
[…] 形式電荷は、どの原子もゼロ。 ※いまいちど、>>既出の講義を参考に、たとえばメタンCH4やエタンCH3CH3の形式電荷を算出しておくと良い。 […]
[…] 窒素N 結合数3 ※ローンペア1個 […]
[…] 窒素N 結合数3 ※ローンペア1個 […]