この記事の要点
- 混成軌道(sp3, sp2, sp)の成り立ちを解説する。
- 混成軌道は、s軌道とp軌道が混ざってできる新しい軌道であり、投入した原子軌道の総数と、形成される混成軌道の総数は等しい(例:1つのs + 2つのp → 3つのsp2)。
- 混成軌道は、電子同士の反発を最小にするため、空間的に最も遠い配置(sp3:四面体、sp2:正三角形、sp:直線)をとる。
- 軌道同士が軸上で正面から重なる結合を、強固な「σ(シグマ)結合」と呼ぶ。
- 混成に関与しないp軌道同士が平行に重なる結合を、比較的弱い「π(パイ)結合」と呼ぶ。
- 単結合はσ結合1つ、二重結合はσ結合1つ+π結合1つ、三重結合はσ結合1つ+π結合2つで構成され、この結合様式が原子の混成状態を決定する。
こんにちは!
ぶっでぃです^^
今回は、結合論(その2-2)「混成軌道の成り立ち」をテーマにお伝えしていきます。
※結合論については有機化学の学習において「基礎中の基礎」となる重要な箇所ですから、かなり重点的にお伝えしています。
※なお、ここで述べることの理論的根拠は量子化学で学びますから、楽しみにしておいてください。
目次
混成軌道の成り立ち
ポイント1 軌道の種類
- s軌道と、p軌道が混成する。
- s軌道と混成するp軌道の数によって、形成する混成軌道の名前が異なる(sp3, sp2, sp)。性質はほとんど等しい。
- 元の原子軌道の総数と、形成する混成軌道の数は等しい。
※例: s軌道 + p軌道(x2) = sp2混成軌道 (x3) + p軌道

ポイント2 軌道の配置
- 同種の混成軌道どうしは、空間的に最も遠くに位置する配置をとる。
- sp3: 結合は4つなので、4面体構造をとるように配置する
- sp2: 結合は3つなので、正三角形を取るように配置する
- sp: 結合は2つなので、原子核を挟んで一直線になるよう配置する
- p: sp混成軌道をとる場合、p軌道は2つになるので、お互いに直交する。
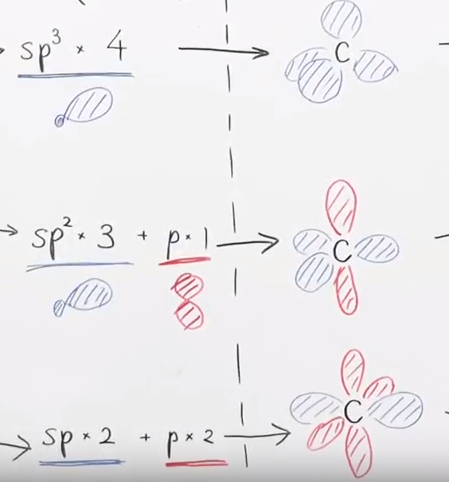
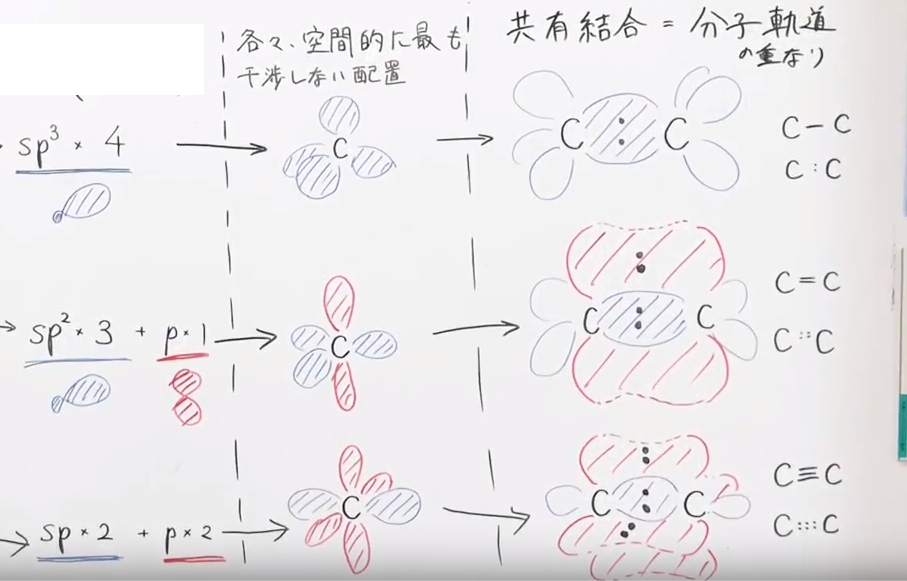
ポイント3 分子軌道の重なりが、共有結合となる
- s軌道、sp3軌道、sp2軌道、sp軌道は、互いに軸を向い合せて結合する。これをσ(シグマ)結合という。
- p軌道は、互いに軸を平行とし、互いの軌道のふくらみを重ね合わせて結合する。これをπ(パイ)結合という。
- σ結合のほうが、π結合よりも軌道の重なり部分が広く、結合としては強固である。

ポイント4 結合様式
- σ結合1つを単結合とよぶ
- σ結合1つ+π結合1つを二重結合とよぶ
- σ結合1つ+π結合2つを三重結合とよぶ
ポイント5 結合様式と、混成様式の関係
- 単結合を形成するにはσ結合が1個形成すればよいので、いかなる混成軌道もしくは原子軌道でも形成しうる。
※例: sp3-sp3、sp3-sp2、sp-s という組み合わせの単結合(=σ結合)は、いずれもありふれた組み合わせの単結合である。 - 二重結合を形成するにはσ結合のほかπ結合を1個形成する必要があるので、少なくともsp2、もしくはsp混成である。
※例1: sp2-sp2 >C=C<
※例2: sp2-sp >C=C=
※例3: sp-sp =C=C= - 三重結合を形成するにはσ結合のほかπ結合を2個形成する必要があるので、必ずsp混成である。
※例: sp-sp -C≡C-
【注目】
【2028年 小児科専攻医 修了まで限定】ぶっでぃの学習指導6年間の集大成 プレゼント開始しました!
※ご注意:予告なく終了することがございます
最終合格率65.0%のプライベート・コンサルティング(20名受講中13名合格)で培った、
勉強法、計画法のノウハウ、二次試験対策コンテンツ、対面指導での質疑などをまとめました。
あなたの医学部編入試験勉強をトータルでサポートする内容で、
得られるベネフィットはプライベート・コンサルティング受講を超える内容です。
ぶっでぃの医学部卒業までに限定してLINE友達登録いただいた方全員にプレゼントいたします。
今すぐ登録してこの1年の勉強に存分に生かしてください。

>>プレゼントページをクリックして詳細をチェック!




コメント
コメント一覧 (2件)
[…] 全ての結合は単結合のみ(=σ結合のみ)なので、電子雲が存在しない ※ここでいう「電子雲」とは、π結合で形成される分子軌道の空間的広がりのこと。この広がりにおいて電子が存在するので「電子雲」とよばれる。π結合の意味がわからない場合は、>>既出の講義を参照のこと。 […]
[…] 全ての結合は単結合のみ(=σ結合のみ)なので、電子雲が存在しない ※ここでいう「電子雲」とは、π結合で形成される分子軌道の空間的広がりのこと。この広がりにおいて電子が存在するので「電子雲」とよばれる。π結合の意味がわからない場合は、>>既出の講義を参照のこと。 […]